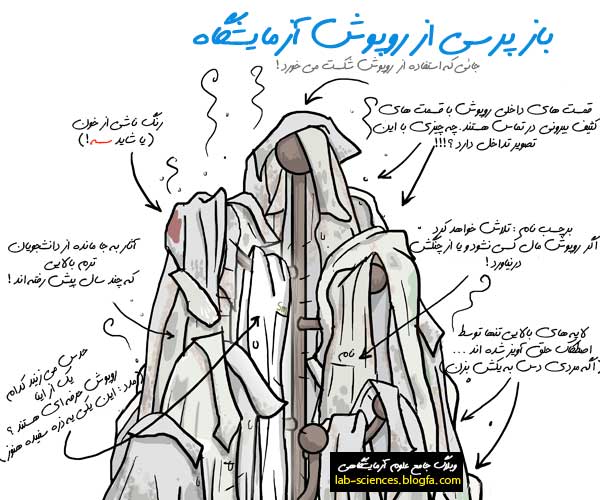
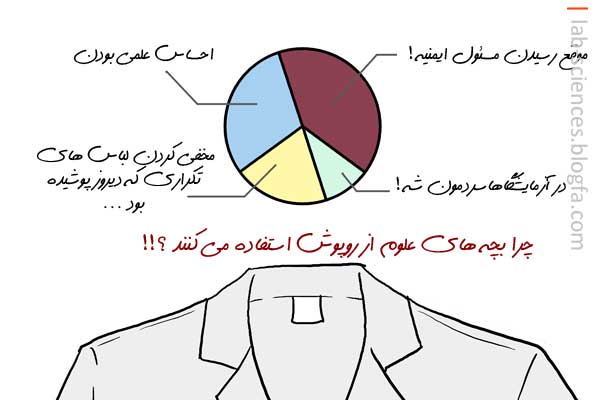
هر سيستمي اعم از جامد، مايع و گاز شامل اتمها يا يونها و يا مولکولهاي ساده اي است که بهم دو نوع نيروي مختلف اعمال مي کنند:
عنوان : گزارش کار آز شیمی فیزیک اندازه گیری انتالپی تبخیر
حالت هاي ماده
هر سيستمي اعم از جامد، مايع و گاز شامل اتمها يا يونها و يا مولکولهاي ساده اي است که بهم دو نوع نيروي مختلف اعمال مي کنند:
1- جاذبه ي بين ذرات
2- انرژي جنبشي
جاذبه ي بين ذرات
جاذبه ي بين اتمها، يونها و ملکولها به موارد زير تقسيم مي شود:
الف: کنش يوني
ب: قيد هيدروژني ( بويژه کنش دو قطبي)
ج: کنش دو قطبي
د: تحريک شدن ناپايدار کنش دو قطبي
انرژي جنبشي
انرژي جنبشي طبق رابطه ي زير داده مي شود:
انرژي جنبشي مستقيماً با دماي مطلق متناسب است، زير سرعت مولکولي (u) يک گاز کامل از رابطه زير به دست مي آيد:
M جرم مولي
حالت هاي جامد، مايع و گاز
در حالت جامد، نيروي جاذبه مولکولي بر نيروي جنبش مولکولي غلبه دارد و موجب مي شود اتمها يا مولکولها در مجاورت يکديگر باقي بمانند.
o در اينجا هندسه ي ثابتي در همسايگي اتمها وجود دارد
o مجموعه ي اتمها داراي شکل و حجم معيني هستند
در مايعات انرژي جنبشي بيشتر از حالت جامدات است. اين انرژي آن اندازه نيست که مولکولها را از هم جدا کند و به اندازه هم کم نيست که مولکولها در محاورت يکديگر ثابت بمانند.
o در اينجا هندسه ي ثابتي در همسايگي اتمها وجود ندارد
o مجموعه ي اتمها داراي شکل ثابتي نيست، اما داراي حجم ثابتي هستند
o جامد و ماده هر دو حالتهاي فشرده ي ماده هستند.
در گازها انرژي جنبشي در يک نقطه بيشتر از نيروهاي جاذبه است، بطوريکه اتمها و مولکولها کاملاً از يکديگر جدا مي شوند.
o مجموعه اتمها منبسط مي شوند و حجم فضايي را که در آن قرار دارند، اشغال مي کنند.
انرژي دروني و تبادل حرارتي
اگر به يک سيستم انرژي گرمايي (q) داده شود، انرژي دروني آن (U) افزايش مي يابد، و اگر سيستم روي محيط کار (w) انجام دهد، انرژي دروني آن کاهش مي يابد بطوريکه:
dU = dq + dw
که در آن کار انجام توسط سيستم منفي در نظر گرفته مي شود.
براي يک سيستم پتانسيلي که کار انبساطي انجام دهد، آنتالپي (H) آن بصورت زير تعريف مي شود.
در اينجا P فشار و V حجم سيستم است.
PV نوعي انرژي است که به حاصلضرب فشار در حجم سيستم مربوط مي شود و کار انجام مي دهد.
در يک فشار ثابت، تغييرات آنتالپي (dH) يک سيستم برابر با گرماي اعمال شده بر سيستم.
بنابراين براي تغييرات جزئي سيستم داريم:
dpdV حاصلضرب دو مقدار کوچک است که با صرف نظر کردن از آن خواهيم داشت:
بنابراين
با جايگذاري (dq + dw) بجاي dU خواهيم داشت
به شرط بودن فشار ، dp برابر صفر خواهد شد و داريم:
در نهايت به قسمت dw توج کنيد. اگر سيستم هيچگونه کار الکتريکي يا مکانيکي و.. انجام ندهد، تنها کاري که مي تواند انجام دهد، کار ناشي از pV (انبساط) است. در صورت ثابت بودن فشار، کار ناشي از انبساط تنها به pdV مربوط خواهد شد.، و هرگاه کار انجام شده منفي باشد، pdV نيز منفي خواهد شد.
براي يک سيستم در فشار ثابت، تغييرات آنتالپي سيستم برابر با گرمايي است که به سيستم داده مي شود.
تبادي حرارتي و تغيير حالت
اگر به مقدار حرارت کسب شده و دماي ماده بررسي شود، مي توان ظرفيت گرمايي مواد را اندازه گيري کرد.
· براي مثال مقدار حرارت لازم براي آنکه فشار در طي يک فرايند ثابت بماند.
· ظرفيت گرمايي در فشار ثابت Cp و گرماي لازم بصورت زير تعريف مي شود.
· بنابراين Cp برابر شيب نمودار آنتلپي (H) و دما (T) است.
براي بسياري از مواد، ظرفيت گرمايي در فشار ثابت در هر دماي اختياري T برابر است با شيب منحني نمودار آنتالپي و دما.
بنابراين روابط بيشتر بصورت هاي زير خواهد بود:
و بالعکس، تغييرا آنتالپي براي رفتن از دماي (T1) به دماي (T2) تابع ظرفيت گرمايي ماده است.
· هنگاميکه Cp در يک محدوده ثابت باشد، خواهيم داشت:
· در حالت کلي که ظرفيت گرمايي Cp تابع دما است با انتگرال گيري از Cp بصورت تابعي از دما خواهيم داشت:
بنابراين ظرفيت گرمايي در فشار ثابت مشتق آنتالپي نسبت به دما است. و تغييرات آنتالپي انتگرال ظرفيت گرمايي در فشار ثابت است.
حالت تغييرات آب
اگر آب را از حالت جامد آن (يخ) از 25°C- مورد بررسي قرار دهيم، و به آن تا +125°Cحرارت بدهيم، (در فشار يک آتمسفر) داده هاي به دست آمده شبيه نمودار زير خواهد شد.
در تمام مراحل اين فرايند، فشار ثابت است.
1- بين منفي 25°C تا o°C شيب نمودار ثابت است.
Cp=37.6 J mol-1 K-1
2- در o°C چنين به نظر مي رسد که گرماي ويژه نامحدود است.
اما آزمايش نشان مي دهد که گرماي ذوب (تابع آنتالپي يخ) 6.01 kJ mol-1 است.
3- بين صفر تا 100 درجه ي سانتيگراد ظرفيت گرمايي آب برابر است با:
75.2 J mol-1 K-1
4- دو باره در 100 ئرجه ي سانتيگراد چنين به نظر مي رسد که گرماي ويژه ي آب ( آب جوش) بي نهايت است. اما تجربه نشان مي دهد که با گرفتن مقداري گرما از حالت مايع به حالت بخار در مي آيد. و براي آنتالپي تبخير داريم:
40.7 kJ mol-1
حال به فرايند زير توجه کنيد که در آن اکسيژن و هيدروژن با يکديگر ترکيب شده و آب توليد مي کنند. در اينجا نيز فشار ثابت است، اما آنتالپي سيستم تغيير مي کند.
در اين فرايند که تبديل گاز به مايع است فشار ثابت مي باشد و آنتالپي سيستم تغيير مي کند.
انتروپي :
معمولاً قانون دوم ترموديناميک را چنين توصيف مي کنند که انتروپي جهان در طي يک فرآيند خود به خودي افزايش مي يابد. سپس ΔS معرفي مي شود. اما حقيقتاً انتروپي را چگونه مي توان توضيح داد؟
قانون دوم ترموديناميک يک برداشت منطقي از تجربه ي بشري است و از تئوري ها و معادلات پيچيده به دست نيامده است. بنابراين فکر کردن در مورد تجارب عادي مي تواند در درک مفاهيم انتروپي بسيار موثر باشد.
اگر سنگي را برداشته و رها کنيم، خواهد افتاد. هنگامي که ماهي تابه را از روي چراغ گاز بر مي داريد، ماهي تابه و مواد داخل آن سرد خواهد شد. آهن در هوا زنگ مي زند. اگر فشار در لاستيک بالا باشد، هوا از يک سوراخ کوچک آن به شدت خارج مي شود تا به فشار پايين اتمسفري برسد. تکه هاي يخ در يک اتاق گرم ذوب مي شوند.
در اين فرآيند ها چه اتفاقي مي افتد؟ بعضي از انواع انرژي از تراکم به پخش شدن تغيير مي يابند. دوباره به مثال ها توجه کنيد تا اين تغيير را در همه ي آن ها بررسي کنيم. و اما قانون دوم ترموديناميک را چگونه مي توان براي توجيه جهان بکار برد؟
انرژي به طور خود به خودي پخش مي شود تا متمرکز نماند البته اگر عاملي آن را به تاخير نياندازد. اما مفهوم انتروپي و جهان چطيست در بسياري از متون مورد بحث قرار مي گيرد؟ به طور خلاصه انتروپي را از نظر مي گذرانيم ولي «جهان» فقط به معني «سيستمي است که شما آن را به همراه محيط اطرافش مي بينيد . يعني هر چيزي که اطراف آن را بسته است». سيستم بعلاوه محيط اطرافش يعني جهان. حال به بررسي چند سيستم مي پردازيم.
۱.سنگ داراي انرژي پتانسيل است و هنگامي که آن را رها مي کنيد انرژي پتانسيل به جنبشي تبديل مي شود. همچنين هنگام سقوط در هوا، مولکول هاي آن را کنار مي زند و مقداري از انرزي سنگ پراکنده مي شود. در مدت برخورد با زمين، مقداري انرژي صوتي ( هواي فشرده ) را پراکنده مي کند و اندکي باعث گرم شدن خود و زميني که به آن برخورد مي کند مي شود. پس از يک دقيقه که مقدار ناچيزي از گرماي برخورد را در هوا پراکنده کرد، ديگر بدون تغيير است. ولي انرژي پتانسيلي که سنگ در لحظه ي رها شدن داشت، اکنون در محيط اطراف پخش شده است کمي در حرکت مولکول هاي هوا و کمي گرم شدن زمين و هوا. سيستم :سنگ بالاي زمين و سپس روي زمين. محيط اطراف:هوا به همراه زمين.
۲.اتم هاي آهن در ماهي تابه داغ به سرعت در حال ارتعاش هستند. بنابراين انرژي حرکتي در ماهي تابه داغ متمرکز است. انرژي حرکتي اگر بتواند پخش مي شود. هر گاه مولکول هاي هواي سردتر اتاق به ماهي تابه داغ برخورد مي کنند اتم هاي مرتعش آهن مقداري از انرژي خود را به مولکول هاي هوا منتقل مي کنند. بنابراين انرژي متمرکز ماهي تابه پخش مي شود و به طور وسيع تر بين مولکول هاي هوا تقسيم مي شود. سيستم: ماهي تابه و محيط اطراف : هواي اتاق.
۳. اتم هاي آهن و مولکول هاي اکسيژن موجود در هوا شامل يک انرژي شيميايي در ميان پيوندهاي شيميايي خود هستند که اين انرژي از انرژي موجود در زنگ آهن (اکسيد آهن) بيشتر است. اين دليل واکنش اکسيژن با آهن است: آزاد کردن انرژي از سطح انرژي بالاتر موجود در پيوندهاي اکسيژن به همراه پيوندهاي آهن و شکل دادن سطح انرژي پايين تر موجود در پيوند هاي اکسيد آهن٫ با همه اين اختلاف در انرژي پخش شدن در محيط اطراف به صورت گرما نيز داريم يعني واکنش گرمازا است و مولکول هاي محيط را وادار مي کند که سريع تر حرکت کنند. سيستم: آهن٫ اکسيژن و اکسيد آهن. محيط اطراف: هواي نزديک٫ رطوبت يا نمک به همراه هر چيزي که با زنگ آهن در تماس است.
انتروپي چيست؟
انتروپي پخش شدن خود به خودي انرژي را نشان مي دهد: در يک دماي خاص،چه مقدار انرژي در يک فرآيند پخش مي شود يا با چه وسعتي پخش مي شود.
ΔS =ΔHfusion/T or ΔHvaporization/T
بعبارت ديگر انتروپي (S) کميتي ترموديناميکي است که اندازهاي براي درجهٔ بينظمي در هر سيستم است. هر چه درجهٔ بينظمي بالاتر باشد، آنتروپي بيشتر است. بنابراين براي يک مادهٔ معين در حالت تعادل دروني کامل داريم:
انتروپي جامد < انتروپي مايع < انتروپي گاز
ميزان کارتورگي يا بينظمي يک سيستم که به عنوان معيار خودبخودي واکنش بکار ميرود، آنتروپي ناميده ميشود که برحسب J/K.mol بوده و با S نمايش داده ميشود.
قانون دوم ترموديناميک و آنتروپي
قانون اول ترموديناميک به معرفي انرژي دروني U منجر شد. اين کميت تابع حالتي است که بر مبناي آن، مجاز بودن يک فرآيند مورد قضاوت قرار ميگيرد و بيان ميدارد که فقط تحولاتي مجاز است که انرژي داخلي کل سيستم منزوي، ثابت بماند. قانوني که ملاک خودبخودي بودن را مشخص ميسازد (قانون دوم ترموديناميک) ، برحسب تابع حالت ديگري بيان ميشود. اين تابع حالت، آنتروپي S است.
ملاحظه خواهيم کرد که بر مبناي آنتروپي قضاوت ميکنيم که آيا يک حالت بطور خودبخودي از حالت ديگري قابل حصول ميباشد. در قانون اول با استفاده از انرژي داخلي، تحولات مجاز مشخص ميشود (آنهايي که انرژي ثابت دارند). از قانون دوم با استفاده از آنتروپي ، تحولات خودبخودي از بين همان فرآيندهايي مشخص ميشود که بر مبناي قانون اول مجاز ميباشد.
بيان قانون دوم
آنتروپي سيستم منزوي در يک فرآيند خودبخودي افزايش مييابد
که ، آنتروپي تمام قسمتهاي سيستم منزوي ميباشد.
از آنجايي که فرآيندهاي برگشت ناپذير (مانند سرد شدن شيئي تا دماي محيط و انبساط آزاد گازها) خودبخودي است، در نتيجه همه آنها با افزايش آنتروپي توام ميباشند. اين نکته را ميتوان به اين صورت مطرح کرد که در فرايندهاي برگشت ناپذير آنتروپي توليد ميشود. از طرف ديگر ، در فرايند برگشت پذير توازن وجود دارد، يعني سيستم با محيط در هر مرحله در تعادل است. هر مرحله بسيار کوچک در اين مسير برگشت پذير بوده و پخش نامنظم انرژي روي نميدهد و در نتيجه آنتروپي افزايش نمييابد، يعني در فرآيند برگشت پذير آنتروپي ايجاد نميشود. آنتروپي در فرآيندهاي برگشت پذير از بخشي از سيستم منزوي به بخش ديگري منتقل ميگردد.
تعريف آماري آنتروپي
بر مبناي تعريف آماري ، فرض ميشود که در واقع ميتوانيم با استفاده از فرمول ارائه شده توسط لووديگ بولتزمن (Ludwing Boltzmann) در سال 1896 ، آنتروپي را محاسبه کنيم:
k ثابت بولتزمن است.
اين ثابت به صورت به ثابت گاز ربط دارد. کميت W تعداد راههاي متفاوتي است که سيستم ميتواند با توزيع اتمها يا مولکولها بر روي حالتهاي در دسترس به انرژي خاصي برسد. واحد آنتروپي با واحد k يکسان است. در نتيجه واحد آنتروپي مولي، ميباشد؛ (اين با واحد R و ظرفيت گرمايي يکي است.
تعريف ترموديناميکي انرژي
در روش ترموديناميکي ، تمرکز بر روي تغيير آنتروپي در طول يک فرايند dS ميباشد، نه مقدار S. تعريف dS بر اين مبناست که ميتوان ميزان پخش انرژي را به انرژي مبادله شده به صورت گرما ، در حين انجام فرايند ربط داد. تعاريف آماري و ترموديناميکي با هم سازگار ميباشند. در شيمي فيزيک اين يک لحظه نشاط آور است که بين خواص تودهاي (که مورد نظر ترموديناميک است) و خواص اتمها يک ارتباط برقرار شود.
تغيير آنتروپي محيط
تغيير آنتروپي محيط را با علامت 'dS نشان ميدهيم. علامت پريم مربوط به محيط سيستم واقعي که در سيستم منزوي بزرگ قرار دارد، مربوط ميشود. محيط را با يک مخزن حرارتي بزرگ (عملا يک حمام آب) نشان مي دهيم که در دماي T باقي مي ماند. مقدار گرماي منتقل شده به مخزن در اثر انجام کار مانند سقوط يک وزنه را با 'dq نشان ميدهيم که اين گرما به مخزن منتقل ميشود. هرچه مقدار گرماي بيشتري به مخزن منتقل شود، حرکت حرارتي بيشتري هم در آن ايجاد ميشود و از اين رو ، پخش انرژي به ميزان بيشتري اتفاق ميافتد. يعني:
از اين نکته استنباط ميشود که اگر گرما به مخزن سردي منتقل شود، کيفيت انرژي نسبت به موردي که آن گرما به مخزن گرمتري داده شود، انحطاط بيشتري خواهد داشت. در مورد اخير ميتوانيم در اثر جاري شدن گرماي 'dq از يک مخزن سرد به مخزن سردتري کار استخراج کنيم، اما اگر اين گرما مستقما به مخزن سردتر منتقل شود، استخراج چنين کاري امکان پذير نيست.
نتيجه ميگيريم که اگر مقدار معين انرژي به صورت گرما به مخزن گرمي داده شود، آنتروپي کمتري ايجاد ميشود تا اينکه آن انرژي به مخزن سردي داده شود. سادهترين راهي که ميتوان اين وابستگي دمايي را به حساب آورد، چنين است.
T دمايي است که در آن دما ، انتقال گرما صورت گرفته است. براي يک تغيير قابل اندازه گيري در دماي ثابت چنين داريم:
وقتي که مقدار زيادي حرکت حرارتي در دماي پايين ايجاد شود، تغيير آنتروپي بزرگي اتفاق ميافتد. براي فرآيند آدياباتيک
q'=0 when ∆S'=0
اين نتيجه براي هر فرآيندي (برگشت پذير يا برگشت ناپذير ) صحيح است. تا زماني که مناطق گرم محلي در محيط ايجاد نشود، يعني زماني اين نتيجه صحيح است که محيط، تعادل دروني خود را حفظ کند. اگر مناطقي محلي بوجود آيد، انرژي از اين مناطق بطور خودبخودي پخش ميشود و در نتيجه آنتروپي توليد ميشود. موقعي که يک واکنش شيميايي با تغيير آنتالپي
∆H
در سيستمي انجام ميشود، گرمايي که در فشار ثابت وارد محيط ميشود، برابر با
بنابراين تغيير آنتروپي محيط برابر است با
انتروپي جامدات
با فرض صادق بودن قانون سوم ترموديناميک ميتوان بصورت زير مقدار مطلقي براي انتروپي جامدات در دماهاي بالا بدست آورد::
در صورتي که مادهٔ مورد نظر در دماهاي بالا تحت استحالههاي فازي قرار گرفته و حالت آن تغيير يابد، بايد از صورت کلي فرمول انتروپي به شکل زير استفاده کرد:
که در اين فرمول، Tm دماي ذوب، Tv دماي جوش،ΔHm تغيير آنتالپي در اثر ذوب، ΔHv تغيير آنتالپي در اثر جوش و (Cp(l)، Cp(s و (Cp(g به ترتيب ظرفيت گرمايي ماده در حالت جامد، مايع و گاز در فشار ثابت هستند.
انتروپي و آنتالپي گازها
جدول زير فشرده اي از روابط بين گرما، حجم، فشار و انتروپي و آنتالپي گازها را ارائه داده است.

آموزش كار و اندازه گيري با كوليس - چهارشنبه سوم آبان 1391
سال 2021 دیگر کسی پیر نمی شود ... - چهارشنبه سوم آبان 1391
دماسنج ـ تاریخچه و کالیبره - سه شنبه دوم آبان 1391
گزارش کار بررسی قوانین سقوط آزاد و اندازه گیری شتاب گرانشی - سه شنبه دوم آبان 1391
بررسی قوانین سقوط ازاد و اندازه گیری شتاب گرانشی - سه شنبه دوم آبان 1391
لیوان جالب جدول تناوبی - یکشنبه سی ام مهر 1391
تبریک به برندگان قرعه کشی مهر ماه فروشگاه شیمیران - جمعه بیست و هشتم مهر 1391
نمک های آب پوشیده و محاسبه ی تعداد مولکول آب تبلور - جمعه بیست و هشتم مهر 1391
سایت رشته صنایع شیمیایی...